ПОРАЖЕНИЕ СЕРДЦА И СОСУДОВ при ревматоидном артрите
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1-24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51-74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Перикардиты — это воспалительные заболевания серозных оболочек сердца. Перикард (околосердечная сумка) представляет собой тонкий и плотный мешок, состоящий из внутреннего и наружного листков, между которыми имеется полость, содержащая около 25 мл жидкости. Перикард отгораживает сердце от других органов грудной клетки, способствует лучшему наполнению предсердий сердца кровью, препятствует его смещению и перерастяжению при физических нагрузках.
Этиология
Ведущую этиологическую роль в развитии перикардитов играют разнообразные инфекционные агенты, в первую очередь вирусы: Коксаки А9, В 1-4, ECHO 8, эпидемического паротита, ветряной оспы, краснухи, иммунодефицита человека, Эпштейна-Барра, цитомегаловирус, парвовирус В 19 и др. (табл. 1). Среди неинфекционных причин перикардитов важное место занимают системные воспалительные ревматические заболевания (РЗ), при которых частота вовлечения перикарда в процесс может достигать 50-80%.
Клинические проявления
В зависимости от клинической картины выделяют следующие виды перикардитов [2]:
• острый (продолжительность менее 6 нед.):
— сухой или фибринозный,
— экссудативный (серозно-фибринозный, геморрагический и гнойный);
• подострый и хронический (продолжительность более 6 нед.):
— экссудативный,
— слипчивый (неконстриктивный),
— констриктивный.
Основная жалоба больных с острым сухим перикардитом — тупая давящая боль в области сердца с иррадиацией в оба плеча, область трапециевидной мышцы, шею. Она усиливается при глубоком дыхании, может сопровождаться одышкой, сухим кашлем, познабливанием, что делает клиническую картину похожей на таковую при остром левостороннем плеврите. Важными особенностями боли при перикардите, в отличие от приступов стенокардии, являются: постепенное нарастание, продолжительность от нескольких часов до нескольких суток, отсутствие эффекта от приема нитроглицерина, временное стихание при приеме наркотических анальгетиков.
Ведущий симптом сухого перикардита — шум трения перикарда, может быть одно-, двух- или трехкомпонентным. Выслушивается над зоной абсолютной тупости сердца и отличается плохой проводимостью («умирает там же, где появляется»). В отличие от клапанных пороков сердца все компоненты шума трения перикарда сходны по характеру и интенсивности («ритм паровоза»).
К наиболее ранним изменениям ЭКГ (I фаза) относят повышение сегмента ST во II-III стандартных отведениях и в отведениях V2-6 c реципрокным снижением ST только в отведениях aVR и V1.Одновременно наблюдается снижение сегмента PR в нижнебоковых отведениях (II, III, aVF, V5-6). Примерно через 1 неделю (II фаза) отмечается возвращение сегментов ST и T к изолинии. После этого происходит инверсия зубца T в большинстве отведений (III фаза). В дальнейшем ЭКГ возвращается к исходной или (при хроническом воспалении) зубцы Т остаются отрицательными (IV фаза).
В отличие от инфаркта миокарда для перикардита, характерно: 1) отсутствие изменений комплекса QRS, 2) быстрая динамика ЭКГ- изменений с инверсией зубца T в течение первых двух суток, 3) инверсия зубца T опережает снижение до изолинии сегмента ST.
При остром перикардите возможны следующие изменения лабораторных показателей: лейкоцитоз, СОЭ, повышенный уровень С-реактивного белка, a2- и g-глобулинов, умеренное повышение параметров, отражающих воспалительный процесс в сердечной мышце (креатинфосфокиназа и ее МВ-фракция, аспарагиновая и аланиновая трансаминазы, лактатдегидрогеназа). В зависимости от предполагаемой причины целесообразно также проведение следующих исследований: туберкулиновая кожная проба, посев крови на гемокультуру (при инфекционном эндокардите), вирусологические исследования, тесты на антитела к ВИЧ, серологические исследования на грибы, определение антинуклеарного фактора, ревматоидного фактора, циркулирующих иммунных комплексов, антител к кардиолипину, титров антистрептолизина-О (при системных РЗ), холодовых агглютининов (при микоплазменных инфекциях), гетерофильных антител (при мононуклеозе) и т.д.
При экссудативном перикардите динамика развития и выраженность симптомов в первую очередь обусловлены скоростью накопления жидкости в перикардиальной полости. В случаях медленного накопления жидкости больные могут не предъявлять сердечных жалоб в течение длительного времени. При достаточно быстром накоплении выпота появляется и нарастает одышка при физической нагрузке, а затем и в покое, которая может уменьшаться в положении сидя с наклоном туловища вперед. Возникает сухой кашель, обусловленный давлением экссудата на трахею и бронхи. При значительном количестве экссудата перкуторно определяется расширение площади сердечной тупости во все стороны. У отдельных больных наблюдается перкуторное притупление и бронхиальное дыхание в области нижнего угла левой лопатки (симптом Эварта). Выслушиваемый ранее (при развитии процесса со стадии сухого перикардита) шум трения перикарда может меняться при перемене положения тела, но, как правило, не исчезает.
На ЭКГ отмечается снижение вольтажа комплексов QRS и зубцов T, депрессия сегмента PR, изменение интервала ST, а также феномен электрической альтернации.
При рентгенографии значительный выпот в полость перикарда проявляется в виде кардиомегалии с четкими границами (конфигурация «бутыли с водой»). Характерно ослабление пульсации сердечной тени. При этом сохраняется четкая пульсация аорты.
Основной метод диагностики экссудативного перикардита — эхокардиография (ЭхоКГ), с помощью которой выявляют расхождение листков перикарда при объеме выпота, превышающем 15-35 мл. Применяют следующие градации выраженности выпота: 1) малый (расхождение листков перикарда <10 мм); 2) умеренный (>10 мм кзади); 3) большой (>20 мм); очень большой (>20 мм плюс симптомы сдавления сердца).
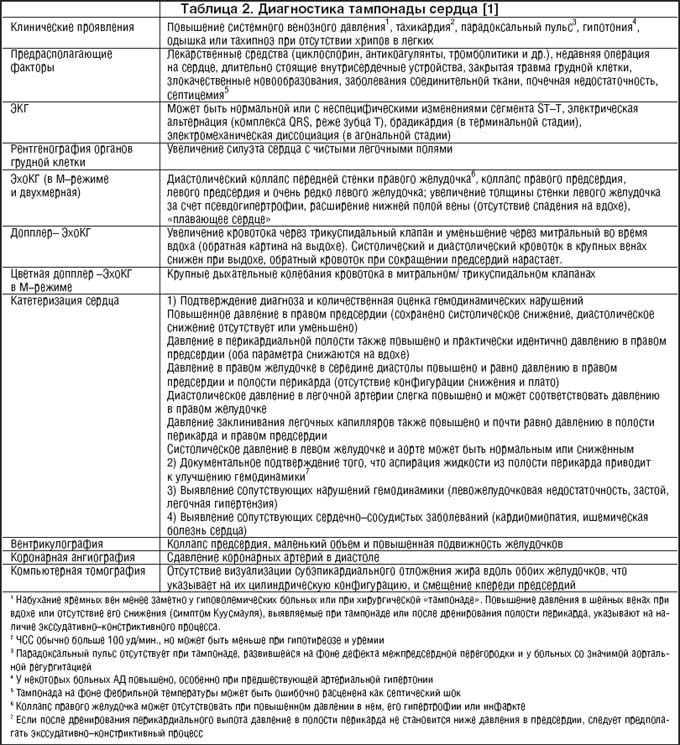
При накоплении перикардиальной жидкости в объеме, затрудняющем ток крови в желудочки, может развиться сердечная тампонада. Чаще она развивается постепенно, клинические симптомы сходны с таковыми при сердечной недостаточности. Важнейший признак сердечной тампонады — «парадоксальный пульс»: снижение систолического АД более чем на 10 мм рт.ст. во время вдоха при неизменном диастолическом АД. Диагностический алгоритм сердечной тампонады представлен в таблице 2.
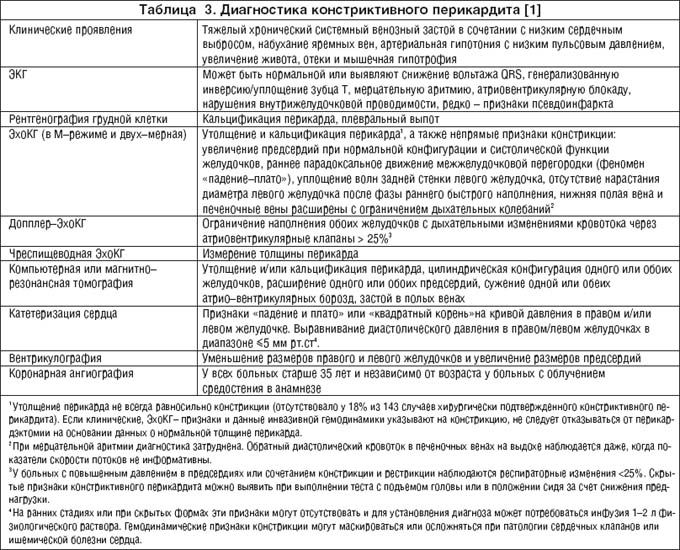
Редким, но крайне тяжелым последствием хронического воспаления перикарда, приводящим к нарушению наполнения желудочков сердца и снижению их функции, является констриктивный перикардит, диагностические признаки которого представлены в таблице 3.
Перикардит при ревматических
заболеваниях
Вопреки распространенному мнению вовлечение в процесс перикарда при острой ревматической лихорадке (ОРЛ) встречается редко. Следует подчеркнуть, что в настоящее время в соответствии с рекомендациями ВОЗ основным критерием ревматического кардита считается вальвулит, возможно, в сочетании с миокардитом или миоперикардитом (панкардит). По материалам Института ревматологии, частота панкардита при ОРЛ составляет 2,5-4,6% у взрослых [3,4] и 6,6% у детей [5]. Поражение сердца по типу миоперикардита при отсутствии вальвулита расценивается как маловероятное для ОРЛ. При этом требуется проведение тщательной дифференциальной диагностики с миоперикардитами другой этиологии, в первую очередь — вирусной.
У больных ревматоидным артритом (РА) частота поражения перикарда колеблется от 15-35% (по данным ЭхоКГ) до 50% (при аутопсии). Клинически манифестный перикардит встречается лишь в 2-4% случаев, как правило, у молодых мужчин с лихорадкой, подкожными узелками, высокими титрами ревматоидного фактора (РФ), умеренной анемией и значительно ускоренной СОЭ. Взаимосвязь частоты развития перикардиальной патологии с длительностью РА не установлена. При РА описаны все виды перикардита (от сухого до констриктивного). У отдельных больных поражение перикарда может быть первым проявлением болезни. В перикардиальной жидкости выявляют лейкоцитоз, высокое содержание белка и цитокинов, уровень сахара и комплемента, как правило, снижен, возможно обнаружение иммунных комплексов, ревматоидного фактора. По сравнению с другими видами экссудативного перикардита (бактериальным, опухолевым) при РА значительно чаще выявляют высокие значения g-глобулинов и ЛДГ в сочетании с низким содержанием глюкозы. Большинство авторов подчеркивают явный эффект от назначения глюкокортикоидов (ГК) и биологических агентов [6,7,8].
У больных системной красной волчанкой (СКВ) перикардит является наиболее частой формой поражения сердца, отражает высокую активность воспалительного процесса и входит (наряду с плевритом) в разряд классификационных критериев болезни. При клиническом и инструментальном исследовании его выявляют в 25-50% случаев, при аутопсии — в 80%. Наиболее характерен сухой перикардит (>20%). У отдельных больных наблюдается значительный выпот в полость перикарда вплоть до тампонады сердца. В перикардиальной жидкости находят LE-клетки, антинуклеарные антитела, иммунные комплексы и низкий уровень комплемента. При длительном течении СКВ и рецидивирующем перикардите развиваются массивные спайки. Для этой группы больных даже вне обострения СКВ характерна стойкая боль за грудиной, в боку, усиливающаяся при смехе, чихании; Длительно может выявляться шум трения перикарда. Крайне редко наблюдается констриктивный перикардит, требующий оперативного лечения [6,9,10].
Поражение перикарда при системной склеродермии (ССД) значительно чаще выявляется при секционном исследовании (50-70%). ЭхоКГ обнаруживает изменения у 40% больных. Клиническая симптоматика склеродермического перикардита скудная и часто отсутствует в связи с особенностями поражения, небольшим количеством жидкости и постепенным затяжным развитием болезни, гемодинамические сдвиги вследствие этого также редки. Необходимость в пункции перикарда возникает в единичных случаях. Общее содержание белка в перикардиальной жидкости меньше, чем в сыворотке крови, соотношение глобулиновых фракций (электрофорез) аналогично. Полагают, что в основе поражения перикарда при ССД лежат явления серозно- фибринозного полисерозита, так и перикардиальный фиброз с нарушением процессов транссудации. ЭКГ- симптомы поражения перикарда нередко отсутствуют. Изменения перикарда встречаются чаще у больных склеродермической нефропатией и иными системными проявлениями болезни (поражение легких, желудочно-кишечного тракта, синдром Шегрена и др.). Считают, что наличие перикардита у больных ССД отражает системность и выраженность патологического процесса [6].
Частота поражения перикарда при других РЗ представлена в таблице 4. С практической точки зрения необходимо отметить возможность развития перикардита в дебюте заболевания, разнообразие форм и вариантов течения перикардиальной патологии (вплоть до тампонады и констрикции), а также в большинстве случаев хороший ответ на терапию ГК (в т.ч. мегадозами).
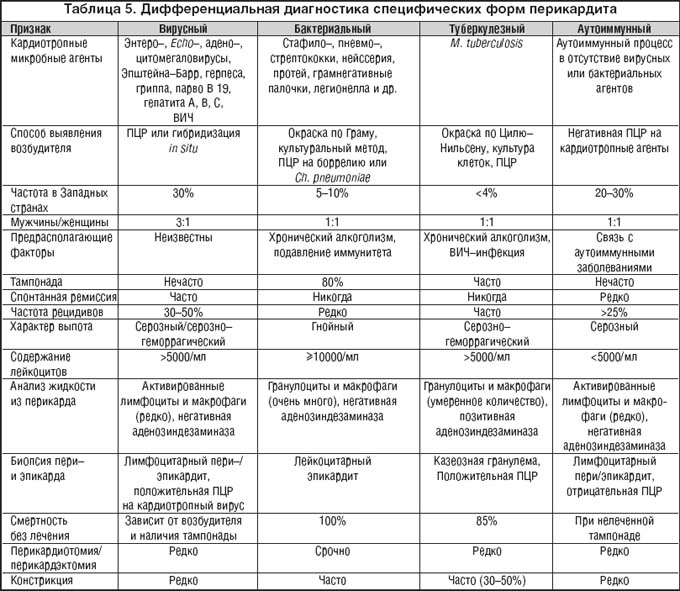
Дифференциальная диагностика перикардитов различного генеза представлена в таблице 5.
Лечение
Основные принципы лечения перикардитов отражены в таблице 6.
В большинстве случаев требуется госпитализация для уточнения этиологии, проведения дифференциальной диагностики, своевременного выявления тампонады сердца и оценки начатого лечения. Основой лечения острого перикардита являются нестероидные противовоспалительные препараты (НПВП) — ибупрофен 1200-2400 мг/сут. и диклофенак 150 мг/сут. внутрь, назначаемые в среднем в течение 3 недель до исчезновения выпота в перикарде. У больных, имеющих язвенные поражения желудочно-кишечного тракта, могут применяться НПВП, относящиеся к селективным ингибиторам циклооксигеназы-2 (мелоксикам, нимесулид). При неэффективности НПВП и прогрессировании процесса начинают (после уточнения этиологии!) лечение преднизолоном в дозе 1-1,5 мг/кг/сут. в течение 5-7 дней с последующим снижением по 2,5 мг каждые 5 дней вплоть до отмены. Общая длительность курса гормонотерапии составляет не < 3 мес. При развитии перикардита в рамках системного заболевания соединительной ткани доза ГК и продолжительность лечения этими препаратами определяется тяжестью и активностью фоновой ревматической патологии.
У большинства больных вирусным перикардитом на фоне противовоспалительной терапии отмечается быстрая положительная динамика и специфическое лечение, как правило, не требуется. При гнойном перикардите необходимо дренирование полости перикарда и промывание ее физиологическим раствором в сочетании с антимикробной терапией. Курс антимикробной терапии следует продолжить до ликвидации лихорадочного синдрома, других клинических признаков болезни и нормализации числа лейкоцитов периферической крови.
Перикардиоцентез показан при клинических симптомах тампонады сердца, предполагаемом диагнозе гнойного или туберкулезного перикардита, большом объеме выпота (расхождение листков перикарда в диастолу на ЭхоКГ >20 мм), сохраняющемся более 1 недели, несмотря на проводимую медикаментозную терапию.
У больных с плотными спайками, локализованным выпотом, рецидивирующей тампонадой, персистирующей инфекцией и прогрессирующим сдавлением сердца необходима перикардэктомия. Периоперационная летальность при перикардэктомии в сочетании с антибиотиками составляет 8%.
Для лечения больных туберкулезным перикардитом используются различные комбинации препаратов, которые следует назначать только при подтвержденном диагнозе. По данным мета-анализа, включавшего больных с выпотным и констриктивным туберкулезным перикардитом, лечение туберкулостатиками в сочетании с ГК ассоциируется с меньшей смертностью и меньшей потребностью в перикардиоцентезе и перикардэктомии. При положительном решении вопроса о назначении преднизолона препарат применяют в относительно высоких дозах (1-2 мг/кг/сут.), т.к. рифампицин усиливает его метаболизм в печени. На 5-7 день лечения дозу преднизолона начинают постепенно уменьшать вплоть до отмены через 6-8 недель. При развитии сдавления сердца выполняют перикардэктомию [15].
Прогноз при острых вирусных перикардитах, как правило, благоприятный. При тампонаде сердца экстренная пункция перикарда улучшает прогноз. 5-летняя выживаемость больных констриктивным перикардитом после перикардэктомии составляет 75%, 10-летняя выживаемость — 57% [2].
При хронической обструктивной болезни легких скорость митрального кровотока снижается почти на 100% во время вдоха и увеличивается на выдохе. При этом значение Е максимально в конце выдоха (при констриктивном перикардите значение Е максимально непосредственно в начале выдоха). Кроме того, кровоток по верхней полой вене при хронической обструктивной болезни легких увеличивается на выдохе, в то время как при констриктивном перикардите при дыхании значимо не изменяется.



Литература
1. Maisch B, Seferovic PM, Ristic AD, et al. Task Force on the Diagnosis and Management of Pricardial Diseases of the European Society of Cardiology. Guidelines on the diagnosis and management of pericardial diseases executive summary; The Task force on the diagnosis and management of pericardial diseases of the European society of cardiology.// Eur Heart J. 2004 Apr;25(7):587-610.
2. Гогин Е.Е. Болезни перикарда. В кн: Рациональная фармакотерапия сердечно-сосудистых заболеваний. М., Литтерра, 2004: 465-482..
3. Асадов А.Г. Физическая работоспособность больных ревмокардитом. Автореф. диссЕканд.мед.наук.М.,1984. 22 с.
4. Джузенова Б.С., Котельникова Г.П., Михайлова И.Н., Насонова В.А. Острый ревмокардит у молодых мужчин. Тер. архив.1992;4: 58-62.
5. Медынцева Л.Г. Физическая работоспособность больных ревматизмом детей на этапе диспансеризации. Автореф. диссЕ. канд. мед. наук. М,1990. 24 с.
6. Сигидин Я,А., Гусева Н.Г., Иванова М.М. Диффузные болезни соединительной ткани (системные ревматические заболевания): руководство для врачей. М., Медицина, 2004. 640 с.
7. Guedes C., Dianchi-Fior P., Cormier B. et al. Cardiac manifeions of rheumatoid arthritis: A case-control transesophageal echocardiography study in 30 patients. Arthritis Care Res. 2001; 45(2): 129-135.
8. McRorie E.R. Wright R.A, Errington M.L., Luoqmani R.A. Rheumatoid constrictive pericarditis. Br.J.Rheumatol.1997; 36: 100-103.
9. Kahl LE. The spectrum of pericardial tamponade in systemic lupus erythematosus. Report of ten patients. Arthritis Rheum. 1992 Nov;35(11):1343-9.
10. Moder KG, Miller TD, Tazelaar HD. Cardiac involvement in systemic lupus erythematosus. Mayo Clin Proc. 1999; 74(3):275-284.
11. Pagnoux C., Guillevin L. Cardiac involvemenrt in small and medium-sized vessel vasculitides. Lupus. 2005; 14: 718-722.
12. Efthimiou P, Paik PK, Bielory L. Diagnosis and management of adult onset Still’s disease. Ann Rheum Dis. 2006; 65(5):564-572.
13. Drout MH, Hachulla E., Houvenagel E. et al [Cardiac complications in adult onset Still disease:from periarditis to tamponade as manifeions. Rev Med Interne. 1994; 15(11): 740-743.
14. Gyongyosi M., Pokorny G., Jambrik Z et al. Cardiac manifeions in primary Sjogren syndrome. Ann Rheum Dis 1996; 55(7): 450-454.
15. Mayosi BM, Nisekhe M., Volmink JA et al. Interventions for treating tuberculous pericarditis. Cochrane Database Syst Rev 2002; (4): CD000526
- Мирский, «Хирургия от древности до современности. Очерки истории.» (Москва, Наука, 2000, 798 с.).
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Противоопухолевая эффективность прототипа лекарственной формы соединения ЛХС-1208 для внутривенного введения // Российский биотерапевтический журнал. 2012. № 2. С. 49.
- https://www.lvrach.ru/2001/03/4528656.
- https://www.rmj.ru/articles/revmatologiya/Perikardity_v_praktike_revmatologa/.
- Ковнер, «Очерки истории M.».