Жигалов С.А., Марасаев В.В.
Введение. Ревматоидный артрит (РА) хроническое системное заболевание соединительной ткани с поражением суставов по типу симметричного эрозивно-деструктивного полиартрита и многочисленными внесуставными проявлениями. Распространенность РА составляет около 0,7%. Ежегодная заболеваемость — приблизительно 0,02% населения. По данным разных авторов поражение почек при РА встречается с различной частотой от 35 до 73% [1,2]. Течение ревматоидной нефропатии носит прогрессирующий характер с развитием нефросклероза и снижением количества функционирующих нефронов, формированием хронической почечной недостаточности.
Развитие системных проявлений предопределяет тяжесть и неблагоприятный прогноз заболевания. Наличие любой стадии хронической болезни почек (ХБП) является независимым фактором риска кардиоваскулярных осложнений [3,4], предопределяющие преждевременную летальность при РА [5,6].
Развитие нефропатий при РА имеет многофакторный характер, что рождает многообразие их клинических и морфологических вариантов при незначительных и неспецифических изменениях в анализах мочи. РА предполагает развитие лекарственной нефропатии, АА-амилоидоза, гломерулонефрита [7].
Последние, как правило, имеют длительное малосимптомное течение, и проявляются в виде незначительных и неспецифических изменений в анализах мочи и зачастую не имеют должной и своевременной интерпретации. Мочевой синдром это клинико-лабораторное понятие, которое включает в себя протеинурию, гематурию (эритроцитурию), лейкоцитурию. Он является важнейшим и наиболее постоянным признаком поражений почек. Наличие мочевого синдрома в рамках современного представления о ХБП служит маркером почечного повреждения и одним из ее критериев. Таким образом, выявление повреждения почек на ранних этапах позволило бы своевременно проводить коррекцию терапии, тем самым влиять на прогноз.
В имеющейся литературе, исследования, касающиеся данной проблемы, немногочисленны и их данные часто противоречивы, что позволяет говорить об актуальности исследования.
Цель исследования — изучить распространенность мочевого синдрома (МС) и его структуру в когорте пациентов с ревматоидным артритом.
Материалы и методы. Проведен анализ встречаемости мочевого синдрома 248 больных РА, проходивших лечение в ревматологическом отделении ГБУЗ Ярославской области «Областная клиническая больница» в 2010 году. В исследование были включены все потупившие больные РА. Оценивались течение основного заболевания и сопутствующая патология. Диагноз достоверного РА ставили на основании критериев американской ревматологической ассоциации (АРА) [8]. Исследовали клинический анализ крови, мочи (по показаниям проводилась проба мочи по Нечипоренко, суточная протеинурия), ультразвуковое исследование почек. Функция почек оценивалась по показателям скорости клубочковой фильтрации (СКФ), которые рассчитывали по формуле MDRD, уровню мочевины и креатинина крови. Иммунологическое исследование включало определение С-реактивного белка (СРБ), ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК). Стадия заболевания определялась по Steinbrocker. Для оценки активности использовался индекс DAS 28: 0 (ремиссия) — DAS 28 меньше 2,6; 1 (низкая) — DAS 28 от 2,6 до 3,2; 2 (средняя) — DAS 28 от 3,2 до 5,1; 3 (высокая) — DAS 28 больше 5,1.
Анализировали течение основного заболевания и сопутствующую патологию. Больные РА были разделены на две группы. Первую составили больные РА без клинически значимой сопутствующей патологии (n=124). Вторую — пациенты с РА имевшие: сердечно-сосудистые заболевания (артериальная гипертензия, ишемическая болезнь сердца, атеросклероз периферических сосудов), n=106, различные заболевания почек (хронический пиелонефрит, мочекаменная болезнь, аномалии развития почек), n=12, и сахарный диабет, n=6. Всего 124 пациента. Группу контроля составили 102 человека репрезентативных по возрасту и не имеющих заболеваний, потенциально влияющих на функциональное состояние почек. Критерием диагностики МС были: протеинурия более 0,3 г/л, эритроцитурия ≥2-х эритроцитов в поле зрения, лейкоцитурия ≥2 в поле зрения у мужчин, и ≥5 в поле зрения у женщин.
Статистический анализ полученных данных проводился с помощью программы ISTICA версия 6.0. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием критериев Колмогорова-Смирнова и Шапиро-Уилка. Для описания нормально распределенных количественных признаков было использовано среднее значение признака и среднее квадратичное отклонение. Для описания признаков, распределение которых отличалось от нормального указаны медиана, нижний и верхний квартили. Для сравнения 2-х групп использовался непараметрический метод Манна-Уитни.
Сравнение 2-х групп по качественному признаку проводилось с использованием критерия Χ2 по методу Пирсона с поправкой Йетса, точного критерия Фишера. Ассоциации качественных признаков проверялись с помощью метода Χ2 по методу Пирсона. Различия и взаимосвязи между признаками считали достоверными при p<0,05.
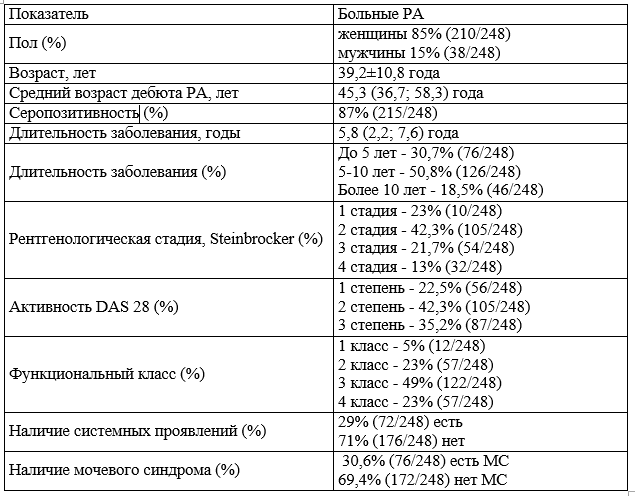
Результаты. Характеристика пациентов основной группы представлена в табл. 1. Средний возраст пациентов 39,2±10,8 года. Подавляющее большинство составили женщины 85% (210/248).
Большинство пациентов получали терапию метотрексатом (МТ): 91% (225/248) человек. Остальные 9% (23/248) человека на момент госпитализации не получали базисную терапию. Глюкокортикостероиды (ГКС) принимали 38% (94/248) человека. В постоянном приеме нестероидных противовоспалительных препаратах (НПВП) нуждались 90% (223/248) пациента. Из них неселективные НПВП принимали 66% (147/223) человек, селективные — 34% (76/223) человек. Не получали НПВП — 10% (25/248) человек.
В качестве системных проявлений были зарегистрированы: ревматоидные узелки, сетчатое леведо, сенсомоторная полинейропатия, анемия, генерализованная амиотрофия.
Таблица 1. Характеристика больных ревматоидным артритом
Структура МС в первой группе больных РА имела следующий вид: протеинурия (П) — 0,8% (1/124), эритроцитурия (Э) — 16% (20/124), лейкоцитурия (Л) — 2,1% (3/124), одновременное появление протеинурии и эритроцитурии (П+Э) — 0,8% (1/124), протениурии и лейкоцитурии (П+Л) — 0% (0/124), лейкоцитурии и эритроцитурии (Л+Э) — 9% (11/124), протеинурии, эритроцитурии и лейкоцитурии (П+Э+Л) — 0,8% (1/124) (рис. 1).
МС во второй группе был представлен следующим образом: П — 2,5% (3/124), Э — 20% (25/124), Л — 3,3% (4/124), П+Э — 0% (0/124), П+Л — 1,6% (2/124), Л+Э — 2,5% (3/124), П+Э+Л — 1,6% (2/124) (рис. 2).
Рис. 1. Структура мочевого синдрома в 1-й группе
Рис. 2. Структура мочевого синдрома во 2-й группе
Патология общего анализа мочи в группе контроля была представлена П — 0% (0/106), Э — 2,8% (3/106), Л — 1,9% (2/106), П+Э — 0% (0/106) П+Л — 0% (0/106), Л+Э — 0,9% (1/106), П+Э+Л — 0% (0/106) (рис. 3).
Рис. 3. Структура мочевого синдрома в группе контроля
Таким образом, мочевой сидром в группе больных с ревматоидным артритом без сопутствующей патологии был определен у 29,8% (37/124), в группе ревматоидного артрита с сопутствующей патологией у 31,4% (39/124) и группе контроля у 5,6% (6/106).
При сравнении полученных относительных частот было показано, что встречаемость мочевого синдрома не имела статистического различия в первой и во второй группах больных РА, (р=0,6), но достоверно отличалась в сравнении с группой контроля (р=0,001).
При сравнении критерием Χ2 по методу Пирсона достоверного различия в структуре первой и второй групп выявлено не было р=0,5.
Таким образом, можно предполагать, что именно наличие РА является фактором, провоцирующим появление мочевого синдрома. Влияния сопутствующей патологии на частоту встречаемости и структуру мочевого синдрома у больных с РА выявлено не было.
Хочется отметить, что в структуре мочевого синдрома превалировала эритроцитурия, как самостоятельно, так и в сочетании с другими показателями.
Для выявления факторов ассоциированных с МС был проведен анализ группы больных с РА без сопутствующей патологии.
При сравнении групп пациентов имеющих МС и без МС было отмечено, что группы достоверно отличались по основным иммунологическим показателям (уровням РФ, ЦИК, СРБ) (табл. 2).
Таблица 2. Иммунологические показатели у больных РА в группе больных без сопутствующей патологии
При изучении встречаемости повышения иммунологических показателей выявлено, что превышение верхней границы референсных значений для ЦИК в группе больных с МС статистически выше, чем в группе без МС 72% (26/36) и 43% (38/88) соответственно, р=0,003. Повышение уровня РФ в группе с МС было достоверно выше, чем в группе без него 95,8% (34/36) и 63% (55/88), р=0,0003. Повышение уровня СРБ в группе с МС составило 90% (32/36) против 64% (56/88) в группе без него, р=0,005. Таким образом, видна отчетливая связь между наличием мочевого синдрома и иммунологическими показателями, отражающими активность основного заболевания.
При изучении влияния активности заболевания на мочевой синдром показано, что встречаемость третьей степени активности в группе больных с МС была достоверно выше, чем в группе без МС (табл. 3).
Таблица 3. Активность РА у больных в группе больных без сопутствующей патологии

При изучении частоты развития системных проявлений сравниваемых групп отмечено, что в группе больных РА имеющих МС системные проявления регистрировались в 42% (15/36) против 23% (20/88) в группе без МС, р=0,03. Не отмечено статистического различия между средними величинами таких показателей как возраст больных 48,8±14, 47,0±11 соответственно, (р=0,55), длительность болезни 4,5 (2,1; 10,5) и 7,2 (2,3; 15,0) соответственно, р=0,2 и дебютом заболевания 46,1 (31,0; 51,2) и 38,5 (27,7; 48,6) соответственно, р=0,25.
При построении таблиц сопряженности и анализе с помощью критерия Χ2 по методу Пирсона выявлено, что МС не ассоциировался со стадией заболевания (р=0,11), ранним дебютом заболевания (до 35 лет), (р=0,12), приемом метотрексата (р=0,3), нестероидных противовоспалительных средств (НПВС) (р=0,23), глюкокортикоидов (р=0,6), селективностью НПВС (р=0,19).
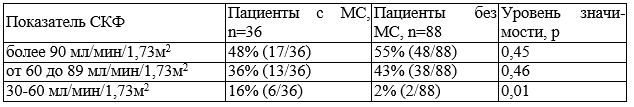
Анализ функционального состояния почек у больных с РА выявил следующее: СКФ более 90 мл/мин/1,73м2 зарегистрирована у 52% (131/248) пациентов, СКФ в диапазоне от 60 до 89 мл/мин/1,73м2 была у 38,4% (95/248) (что соответствует 2 ст. ХБП), у 8,8% (22/248) — менее 60 мл/мин/1,73м2 (что соответствует 3 ст. ХБП).
При этом частота встречаемости нарушений СКФ была ассоциирована с наличием сопутствующей патологии, влияющей на функциональное состояние почек (p<0,001). В то же время, частота встречаемости различной СКФ существенно не зависела от рентгенологической стадии и функционального класса. При сравнении относительных частот было выявлено, что среди больных с сопутствующей патологией снижение СКФ менее 60 мл/мин/1,73м2 регистрировалось статистически чаще, чем среди пациентов без заболеваний сердечно-сосудистой системы и почек 13% (16/124) и 4,8% (6/124) соответственно, p<0,02.
Для выявления взаимосвязи мочевого синдрома и снижения СКФ была проанализирована группа больных РА не имеющих сопутствующих заболеваний (n=124). Показано, что в группе с наличием МС встречаемость СКФ менее 60 мл/мин/1,73м2 статистически превышает такой показатель в группе без МС (табл. 4).
Таблица 4. СКФ у больных РА в зависимости от наличия мочевого синдрома
Обсуждение. При анализе полученных данных было показано, что распространенность мочевого синдрома среди больных РА достаточно велика и составляет около трети всех пациентов (30,6%). При этом наличие сопутствующей патологии достоверно не влияла на частоту его встречаемости, что вероятно, позволяет говорить о РА, как о причине появления МС. Увеличение частоты встречаемости МС почти в два раза при наличии системных проявлений РА, свидетельствует в пользу данного утверждения. Таким образом, наличие МС при РА может служить ранним маркером повреждения почек и служить «отправной точкой» для дальнейшего обследования.
Научный журнал
Фундаментальные исследования
ISSN 1812-7339
«Перечень» ВАК
ИФ РИНЦ = 1,441
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ФАКТОРЫ РИСКА ПОРАЖЕНИЯ ПОЧЕК ПРИ РЕВМАТОИДНОМ АРТРИТЕ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Батюшин М.М. 1 Выставкина Е.А. 1
1 ГБОУ ВПО «Ростовский государственный медицинский университет МЗ и СР РФ», Ростов-на-Дону
Обследовано 100 пациентов с ревматоидным артритом с целью изучить распространенность клинических проявлений поражения почек. У больных ревматоидным артритом хроническая болезнь почек 1-3 стадий выявлялась в 36 %. В 31 % случаев имелось снижение скорости клубочковой фильтрации менее 90 мл/мин/1,73 м2, микроальбуминурия выявлена в 24 %, протеинурия — в 11 %, лейкоцитурия — в 36 %, гиперкреатинемия и повышение мочевины и мочевой кислоты крови в 7 %. Таким образом, у больных с ревматоидным артритом для своевременного выявления почечной патологии необходимо определять уровень скорости клубочковой фильтрации и при его снижении проводить дальнейшую оценку функционального состояния почек.
ревматоидный артрит
хроническая болезнь почек
скорость клубочковой фильтрации
почечная дисфункция
1. Диагностика и лечение болезней почек / Н.А. Мухин, И.Е. Тареева, Е.М. Шилов, Л.В. Козловская. — М.: ГЭОТАР-Медиа, 2008. — 384 с.
2. Калюжина М.И. Функционально-морфологическое состояние почек у больных ревматоидным артритом // Бюллетень Сибирской медицины. — 2009. — Т. 8, №4(2). — С. 51-54.
3. Мавлянов И.Р., Акбарова Г.П., Хабилова Н.Л. Состояние тубулоэпителиальной системы почек у больных ревматоидным артритом в зависимости от длительности заболевания // Профилактическая медицина. — 2009. — №3. — С. 14-17.
4. Попкова Т.В., Новикова Д.С., Писарев В.В. Факторы риска кардиоваскулярных заболеваний при ревматоидном артрите // Научно-практическая ревматология. — 2009. — №3. — С. 4-11.
5. Функциональное состояние почек при ревматоидном артрите / Н.А. Храмцова, А.А. Дзизинский, Н.В. Земляничкина, Е.В. Трухина // Кардиоваскулярная терапия и профилактика. — 2008. — Т. 7, №6 (прил.). — С. 394.
В последнее время внимание клиницистов привлекает высокая частота нарушений функции почек при многих распространенных в популяции заболеваниях [1]. Почки при ревматоидном артрите (РА) могут исходно поражаться как вследствие основного заболевания (антигенная агрессия соединительнотканной стромы почек), так и за счет сопутствующей патологии самой почки, проявляющейся при использовании нестероидных противовоспалительных препаратов [2]. Несмотря на некоторую общность механизмов развития повреждения почек при РА и таких заболеваниях, как артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет 2 типа, при хроническом воспалительном заболевании суставов необратимая утрата функции почек встречается реже [3]. Возможно, РА приводит к снижению функции почек или усугублению уже имеющихся нарушений [4]. Исследования, посвященные изучению патологии почек у больных РА, в которых отражалось бы влияние клинических, лабораторных и инструментальных данных, а также сопутствующей терапии артрита на формирование почечной дисфункции, малочисленны либо противоречивы, что определяет актуальность последующего изучения данной проблемы.
Целью работы явилось изучение распространенности клинических проявлений поражения почек у больных РА и определение факторов риска почечной дисфункции при хроническом заболевании суставов.
Материалы и методы исследования
Проведенное исследование было открытым сравнительным рандомизированным. Основу работы составили результаты комплексного клинического, инструментально-лабораторного обследования 100 больных РА (80 женщин и 20 мужчин). Возраст больных клинической группы варьировал от 20 до 78 лет, в среднем составив 53,7 ± 1,1 лет. Критериями включения пациентов в исследование были: возраст 18 лет и старше, верифицированный диагноз РА в соответствии с критериями Американской коллегии ревматологов (ACR, 1987), информированное согласие. Критериями исключения явились клинически значимые заболевания внутренних органов — умеренная и тяжелая формы хронической недостаточности кровообращения, органическая патология почек, не связанная с РА, печеночная недостаточность, сахарный диабет, хроническая болезнь почек (ХБП) 4-5 стадии (СКФ ≤ 29 мл/мин/1,73 м2). Пациенты клинической группы в зависимости от наличия либо отсутствия клинических признаков поражения почек были разделены на две группы. 1-ю группу составили 64 (64,0 %) пациента, у которых почечная дисфункция отсутствовала, а 2-ю группу — 36 (36,0 %) больных с наличием почечной дисфункции. Внутри 2-й группы среди больных РА выделялись подгруппы с разной вовлеченностью почек в патологический процесс: в зависимости от значения скорости клубочковой фильтрации (СКФ) (СКФ ≥ 90 мл/мин/1,73 м2; СКФ 60-89 мл/мин/1,73 м2 и СКФ 30-59 мл/мин/1,73 м2), наличия или отсутствия микроальбуминурии (МАУ), протеинурии, уровня экскреции альбумина и белка с мочой.
Изучение функционального состояния почек включало общий анализ мочи, анализ мочи по методике Зимницкого, Каковского-Аддиса; определение скорости клубочковой фильтрации по формулам Кокрофта-Гаулта и MDRD (Modification of Diet in Renal Disease Study), проведение пробы с сухоядением. Для оценки концентрационной способности почек по результатам пробы Зимницкого вычисляли концентрационный индекс (КИ) по формуле КИ = ∆уд. вес∙ДД/НД, где дневной диурез — ДД, ночной диурез — НД, ДД/НД, разница максимального удельного веса мочи к минимальному — ∆уд. вес. В норме КИ должен составлять более 24,7. Также проводили ультразвуковое исследование почек, оценивали наличие и выраженность МАУ, протеинурии. При биохимическом анализе крови производилось определение общего белка, альбумина, преальбумина, креатинина, мочевой кислоты, соотношения альбумин/креатинин, общего холестерина, липопротеидов низкой плотности, высокой плотности, триглицеридов, глюкозы.
Результаты исследования были обработаны с помощью компьютерной программы istica 7.0 с применением методов описательной статистики, таблиц сопряженности, дисперсионного анализа.
Результаты исследования и их обсуждение
Среди 100 больных клинической группы у 64 (64 %) пациентов ХБП не выявлялась (1-я группа). Соответственно 36 (36 %) больных вошли во 2-ю группу. Среди больных 2-й группы 1-я стадия ХБП была установлена у 5 (13,9 %) пациентов: у 4 пациентов на основании выявления персистирующей МАУ, а у одного больного — на основании персистирующего мочевого синдрома в виде эритроцитурии. Незначительное снижение СКФ (60-89 мл/мин/1,73 кв. м) было отмечено у 21 (58,3 %) больного РА со 2-й стадией ХБП. У 10 (27,7 %) больных с 3-й стадией ХБП имелось умеренное снижение СКФ в диапазоне 30-59 мл/мин/1,73 кв. м. Нормальная или повышенная СКФ (90 и более мл/мин/1,73 кв. м) была определена у 5 пациентов 2-й группы. Достоин внимания малый удельный вес больных РА с нормальной или повышенной СКФ (90 и более мл/мин/1,73 кв. м) среди больных 2-й группы с ХБП. Возможно, для развития гипофильтрации при РА нехарактерно наличие предшествующей гиперфильтрационной фазы.
В общем по группе МАУ наблюдали у 24 %, а протеинурия выявлялась у 11 % больных. Во 2-й группе пациентов МАУ отмечали у 4 больных с 1-й стадией ХБП, у 20 пациентов со 2-й стадией, а протеинурию — у 1 больного со 2-й и у 10 больных с 3-й стадией ХБП. Всего во 2-й группе МАУ была выявлена у 24 (66,7 %), а протеинурия — у 11 (30,6 %) больных.
Cредний уровень креатинина у больных РА составил 79,4 ± 1,8 мкмоль/л, размах колебания составил от 61 до 135 мкмоль/л. Гиперкреатинемия (у мужчин выше 115 мкмоль/л, у женщин — выше 97 мкмоль/л) наблюдалась в 7 случаях (7 %).
У пациентов РА мочевина крови колебалась от 2,9 до 13,7 ммоль/л, в среднем составив 5,9 ± 0,2 ммоль/л. Повышение мочевины выше нормы (8,3 ммоль/л) выявлялось у 7 больных (7 %).
Мочевая кислота является маркёром расстройств пуринового обмена [5]. Во-первых, её повышение свидетельствует о ретенции почечной элиминации или гиперпродукции мочевой кислоты. Первое относится к числу проявлений почечной дисфункции, второе — к гиперметаболизму вследствие избыточного поступления в организм белковых продуктов или повышенной деградации эндогенного белка. Во-вторых, уровень мочевой кислоты повышается при сосудистом воспалении, ожирении и является компонентом кардиометаболического синдрома [4]. У пациентов с РА мочевая кислота имела среднюю величину 267,3 ± 10,3 мкмоль/л при диапазоне колебаний от 128 до 650 мкмоль/л. Повышение мочевой кислоты выше нормы (у мужчин — 420 мкмоль/л, у женщин —
340 мкмоль/л) в клинической группе наблюдалось у 19 %.
На следующем этапе исследования основные показатели, отражающие функциональное состояние почек, были проанализированы отдельно в группах с наличием или отсутствием ХБП (табл. 1).
У больных 2-й группы при присоединении ХБП происходило снижение СКФ на 43,9 % (p < 0,001), возрастал уровень суточной протеинурии в 833,5 раз (p < 0,001), содержание креатинина — на 8,9 % (p < 0,05).
При предварительной оценке удельного веса мочи по итогам общего анализа было установлено, что в общем по группе относительная плотность мочи колебалась от 1005 до 1034, среднее значение составило 1014,2 ± 0,6. В 1-й группе относительная плотность мочи варьировала от 1005 до 1034, во 2-й группе — от 1005 до 1025. Средняя величина удельного веса мочи у больных 1-й группы была 1013,9 ± 0,79, 2-й группы — 1014,7 ± 0,77. Среднее значение относительной плотности мочи у больных 1-й и 2-й групп, а также в общем по клинической группе было немногим меньше нижней границы нормы. По итогам пробы по Зимницкому было установлено, что в общем по группе, а также в 1-й группе концентрационная и водовыделительная способность почек была в норме. У больных 2-й группы нарушалась концентрационная способность почек, поскольку относительная плотность мочи была ниже 1020. Способность к разведению мочи у больных 1-й и 2-й групп была в норме и находилась ниже уровня 1010-1012. Снижение максимального значения относительной плотности мочи у пациентов 2-й группы приводило к снижению размаха и свидетельствовало об ограничении способности почек к осмотическому концентрированию мочи. У больных 2-й группы концентрационный индекс был ниже по сравнению с 1-й группой на 33,5 % (p < 0,001) (62,2 ± 10,4 против 93,6 ± 9,1).
Таблица 1
Показатели функционального состояния почек у больных РА
Показатель | В общем по группе | 1-я группа, n = 64 | 2-я группа, n = 36 | р1-2 |
СКФ, мл/мин/1,73 кв. м | 58,4 ± 6,6 | 95,7 ± 3,1 | 53,7 ± 2,4 | < 0,001 |
Количество больных с МАУ, (абс., %) | 24 (24,0) | — | 24 (24,0) | — |
Количество больных с протеинурией, (абс., %) | 11 (11,0) | — | 11 (11,0) | — |
Суточная протеинурия, мг/сут | 66,8 ± 23,1 | 0,2 ± 0,16 | 166,7 ± 54,5 | < 0,001 |
Креатинин, мкмоль/л | 79,4 ± 1,8 | 76,7 ± 2,4 | 83,5 ± 2,8 | < 0,05 |
Мочевина, ммоль/л | 5,9 ± 0,2 | 5,7 ± 0,2 | 6,3 ± 0,4 | > 0,05 |
Мочевая кислота, мкмоль/л | 267,3 ± 10,3 | 270,9 ± 13,6 | 261,9 ± 16,1 | > 0,05 |
У больных 1-й группы проба с сухоядением была в норме: объем порций мочи, собираемой каждые 2 часа, уменьшался до 30-60 мл в порции, суточный диурез снижался до 300-400 мл, относительная плотность мочи нарастала до 1028-1032. У больных 2-й группы наблюдалась пониженная концентрационная способность почек: количество мочи и величина отдельных порций мочи были больше нормальных. Относительная плотность мочи увеличивалась только до 1020-1022.
Содержание форменных элементов в моче у больных РА оценивали по результатам общего анализа мочи и пробы по Каковскому-Аддису (табл. 2).
Таблица 2
Содержание форменных элементов в моче по результатам
общего анализа мочи и пробы по Каковскому-Аддису (М ± m)
Показатель | В общем по группе | 1-я группа | 2-я группа | р1-2 |
Лейкоциты в п.зр. | 6,6 ± 1,5 | 2,9 ± 0,2 | 7,3 ± 1,3 | < 0,001 |
Эритроциты в п.зр. | 0,26 ± 0,08 | 0,1 ± 0,04 | 0,55 ± 0,18 | > 0,05 |
Лейкоциты, ∙106/сут | 4,5 ± 1,3 | 0,9 ± 0,11 | 7,59 ± 1,52 | < 0,001 |
Эритроциты, ∙106/сут | 0,11 ± 0,04 | 0,1 ± 0,03 | 0,2 ± 0,08 | > 0,05 |
Цилиндры, ∙106/сут | 0,06 ± 0,05 | — | 0,06 ± 0,05 | > 0,05 |
В общем в клинической группе средние величины количества лейкоцитов в поле зрения и их суточное выделение с мочой превышали верхнюю границу нормы и соответствовали лейкоцитурии. Как известно, лейкоцитурия является маркёром интерстициального нефрита лекарственного либо инфекционного генеза при отсутствии инфекции мочевых путей. У обследованных больных РА инфекции мочевых путей отсутствовали, следовательно, лейкоцитурия, вероятно, была следствием нефрита. При дифференцированном анализе по группам установлено, что в 1-й группе содержание форменных элементов мочи было в норме, а у пациентов 2-й группы лейкоцитурия была обнаружена как при общем анализе мочи, так и при проведении пробы по Каковскому-Аддису. Содержание эритроцитов и цилиндров было в норме.
Проведение дисперсионного анализа с вычислением критерия Фишера и его доверительной вероятности показало, что факторами, которые одновременно у больных РА обеспечивают снижение СКФ и МАУ, являются возраст, длительность и степень активности РА, АГ, пульсовое давление, уровень холестерина крови. Развитию одновременного снижения СКФ и протеинурии у пациентов с РА способствовали длительность и степень активности РА, АГ, пульсовое давление, уровень холестерина и глюкозы крови.
Итак, больные РА являются группой повышенного риска почечной патологии, вероятность развития которой возрастает при продолжительном и активном течении РА. Клинические симптомы почечной дисфункции у больных РА при высокой активности и продолжительности основного заболевания, а также при выявлении артериальной гипертензии и дислипидемии должны быть основанием для активного диспансерного наблюдения за больными. Такой подход направит усилия клиницистов на своевременное лечение патологии почек у больных РА, что позволит продлить жизнь пациентам и улучшить ее качество.
Выводы
1. Среди больных РА распространенность ХБП составляет 36 % и проявляется снижением СКФ менее 90 мл/мин/1,73 м2 у 31 %, МАУ у 24 %, протеинурией у 11 %, гиперкреатинемией и повышением мочевины и мочевой кислоты крови у 7 % больных, лейкоцитурией, снижением концентрационной функции почек по результатам проведения пробы с сухоядением.
2. У больных РА развитие ХБП и степень выраженности ее проявлений определяются длительностью и активностью основного заболевания, возрастом, наличием артериальной гипертензии, дислипидемией и повышением уровня глюкозы крови.
Рецензенты:
Абоян И.А., д.м.н., профессор, главный врач МЛПУЗ Клинико-диагностический центр «Здоровье», г. Ростов-на-Дону;
Пакус И.О., д.м.н., профессор, главный врач ГБУ РО «Областная клиническая больница №2», г. Ростов-на-Дону.
Работа поступила в редакцию 17.10.2011.
Библиографическая ссылка
Батюшин М.М., Выставкина Е.А. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ФАКТОРЫ РИСКА ПОРАЖЕНИЯ ПОЧЕК ПРИ РЕВМАТОИДНОМ АРТРИТЕ // Фундаментальные исследования. — 2012. — № 2-2. — С. 249-252;
URL: https://fundamental-re.ru/ru/article/view?id=29487 (дата обращения: 23.07.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
- Мустафин Р. И., Буховец А. В., Протасова А. А., Шайхрамова Р. Н., Ситенков А. Ю., Семина И. И. Сравнительное исследование поликомплексных систем для гастроретентивной доставки метформина. Разработка и регистрация лекарственных средств. 2015; 1(10): 48–50.
- Киржанова Е. А., Хуторянский В. В., Балабушевич Н. Г., Харенко А. В., Демина Н. Б. Методы анализа мукоадгезии: от фундаментальных исследований к практическому применению в разработке лекарственных форм. Разработка и регистрация лекарственных средств. 2014; 3(8): 66–80. DOI: 10.33380/2305-2066-2019-8-4-27-31.
- Мирский, «Медицина России X—XX веков» (Москва, РОССПЭН, 2005, 632 с.).
- https://vrach-aspirant.ru/articles/rheumatology/13053/.
- https://fundamental-research.ru/ru/article/view?id=29487.
- Мустафин Р. И., Буховец А. В., Протасова А. А., Шайхрамова Р. Н., Ситенков А. Ю., Семина И. И. Сравнительное исследование поликомплексных систем для гастроретентивной доставки метформина. Разработка и регистрация лекарственных средств. 2015; 1(10): 48–50.
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Противоопухолевая активность соединения ЛХС-1208 (N-гликозилированные производные индоло[2,3-а]карбазола) // Российский биотерапевтический журнал 2010. № 1. С. 80.
- ОФС.1.2.1.1.0003.15 Спектрофотометрия в ультрафиолетовой и видимой областях // Государственная фармакопея, XIII изд.
- Bangun H., Aulia F., Arianto A., Nainggolan M. Preparation of mucoadhesive gastroretentive drug delivery system of alginate beads containing turmeric extract and anti-gastric ulcer activity. Asian Journal of Pharmaceutical and Clinical Research. 2019; 12(1):316–320. DOI: 10.22159/ajpcr.2019.v12i1.29715.