Ревматоидный артрит (РА) относится к числу наиболее распространенных и тяжелых хронических воспалительных заболеваний человека, которое в отсутствие эффективной терапии приводит к быстрой инвалидизации и сокращению продолжительности жизни пациентов [1,2]. Однако в последние годы взгляд на РА как на потенциально неизлечимое и прогностически неблагоприятное заболевание пересматривается [3,4]. Это во многом связано с расширением возможностей ранней диагностики РА, что позволяет начинать активную терапию в дебюте болезни, и разработкой нового класса базисных противовоспалительных препаратов (БПВП), так называемых «генно-инженерных биологических агентов», которые селективно блокируют важные звенья иммунопатогенеза РА [3].
До недавнего времени патогенетические механизмы развития РА рассматривались главным образом с точки зрения дефектов Т-клеточной иммунорегуляции и гиперпродукции «провоспалительных» цитокинов, в первую очередь фактора некроза опухоли (ФНО)-a, а также интерлейкина (ИЛ)-1 и ИЛ-6 [5-7].Это послужило основанием для широкого внедрения в клиническую практику ингибиторов ФНО-a, к которым относятся химерные (инфликсимаб) и полностью человеческие антитела к ФНО-a и др. [8,9], и рекомбинантный рецепторный антагонист ИЛ-1. Применение этих препаратов, в первую очередь ингибиторов ФНО-a, позволило добиться поразительных успехов в лечении РА, которые были недостижимы при применении «стандартных» химических БПВП и глюкокортикоидов. Тем не менее остается немало пациентов, которые резистентны к ингибиторам ФНО-a, имеют серьезные противопоказания к их применению, а у ряда больных могут развиться тяжелые побочные эффекты. Кроме того, РА весьма гетерогенное с точки зрения патогенетических механизмов заболевание, а гиперпродукция ФНО-a является хотя важнейшим, но далеко не единственным механизмом воспаления и тканевой деструкции при РА.
Напомним, что одна из первых концепций иммунопатогенеза РА основывалась на представлении об этом заболевании, не как о «Т-клеточной цитокинзависимой» патологии, а как о В-клеточной иммунокомплексной болезни, в развитии которой основное значение придавали синтезу ревматоидных факторов (РФ) [10,11]. Действительно, РФ, представляющий собой аутоантитела, специфически реагирующие с константным участком IgG1, обнаруживается в сыворотках более чем 80% страдающих РА, а «серопозитивность» по РФ ассоциируется с тяжелым течением и неблагоприятным прогнозом. РФ (РФ-содержащие иммунные комплексы) обладают выраженным патогенным потенциалом. С другой стороны, данные экспериментальных исследований свидетельствуют о фундаментальной роли В-лимфоцитов в иммунопатогенезе РА. Например, при изучении экспериментального артрита у мышей с тяжелым комбинированным иммунодефицитом (NOD-SCID), развивающимся при переносе синовиальной ткани от пациентов с активным РА, было показано, что В-лимфоциты участвуют в активации CD4+ Т-клеток по Th2 типу в воспаленной синовиальной ткани, выполняя функцию специфических антиген-презентирующих клеток. В-клетки, синтезирующие РФ, обладают уникальной способностью взаимодействовать с иммунными комплексами и «презентировать» широкий спектр аутоантигенов, а активированные В-клетки экспрессируют ко-стимуляторные молекулы (B7 и CD40), необходимые для полноценной активации Т-клеток. Обсуждается и эффекторная роль В-клеток в развитии суставной деструкции при РА, которая реализуется за счет синтеза «провоспалительных» цитокинов (ФНО-a, ИЛ-1 и лимфотоксин), а также ИЛ-6 и ИЛ-10, которые оказывают дополнительное стимулирующее действие на В-лимфоциты.
Все это вместе взятое послужило теоретической базой для изучения эффективности препарата ритуксимаб (МабТера®, «Ф.Хоффманн-Ля Рош Лтд.» (Швейцария)), который представляет собой генноинженерные химерные высокоаффинные моноклональные антитела к поверхностным рецепторам В-лимфоцитов — CD20 (человеческий IgG каппа и фрагмент мышиных анти-CD20 антител IDEC-C2B8) при РА и других аутоиммунных ревматических заболеваниях [12,13] (рис. 1). Напомним, что в процессе созревания от стволовых клеток в плазматические клетки В-лимфоциты проходят несколько последовательных стадий, для каждой из которых характерна экспрессия определенных дифференцировочных мембранных антигенов. CD20 — клеточный мембранный антиген, экспрессия которого характерна для «ранних» и зрелых В-лимфоцитов, но не стволовых, «ранних» пре-В, дендритных и плазматических клеток (рис. 2). Уникальная роль CD20, как мишени для фармакологических воздействий, связана с несколькими обстоятельствами. CD20 не высвобождается с мембраны В-лимфоцитов и поэтому не присутствует в свободной (циркулирующей) форме, которая потенциально может препятствовать взаимодействию анти-CD20 антитела с мембранной CD20 молекулой. CD20 не экспрессируется на стволовых, «ранних» пре-В и плазматических клетках. Поэтому удаление CD20 В-лимфоцитов, не нарушает В-клеточный иммунный ответ. Полагают, что действие ритуксимаба заключается в удалении В-лимфоцитов, которое реализуется за счет комбинации нескольких механизмов, включающих комплемент-зависимую клеточную цитотоксичность, антитело-зависимую клеточную цитотоксичность и индукцию апоптоза [14].
В настоящее время проведены многочисленные исследования, подтвердившие высокую эффективность ритуксимаба при РА, как у больных, резистентных к терапии «стандартными» БПВП, так и ингибиторами ФНО-a [15-24], характеристика которых частично представлена в наших предыдущих публикациях [15].
Особый интерес представляют результаты 3 международных многоцентровых РКИ (табл. 1), результаты которых послужили основанием для регистрации ритуксимаба для лечения РА в США (FDA), странах Западной Европы (EMEA) и России, в первую очередь у пациентов, не «отвечающих» на лечение ингибиторами ФНО-a.
В первое РКИ вошел 161 пациент с активным РА, несмотря на лечение не менее 5 БПВП, включая метотрексат (МТ) [22]. При этом одним из критериев включения была сохраняющаяся активность РА на фоне лечения МТ в дозе менее 10 мг/нед. в течение 4 и более недель до начала исследования. Пациенты были рандомизированы на 4 группы: группа 1 — только МТ (> 10 мг/нед.); группа 2 — только ритуксимаб (1 г 2 раза на первый и 15 день); группа 3 — ритуксимаб в той же дозе в сочетании с циклофосфамидом (ЦФ) (750 мг на 3 и 17 дни); группа 4 — ритуксимаб и МТ. Все пациенты получали глюкокортикоиды в течение первых 17 дней испытания (общая доза 910 мг: метилпреднизолон в/в 100 мг в сутки 1, 3, 15 и 17, в сочетании с преднизолоном п/о 60 мг/сут. со 2 по 4-7 дни и 30 мг/сут. с 8 по 14 дни). У пациентов, получавших комбинированную терапию, эффективность терапии (число пациентов с ответом по ACR50) была достоверно выше, чем у пациентов, получавших монотерапию МТ (p<0,005). По критерию ACR20 у пациентов всех трех групп, получавших ритуксимаб, эффективность была выше, чем на фоне монотерапии МТ (p=0,025-0,001). Наиболее высокая частота ответа по ACR70 имела место у пациентов, получавших ритуксимаб и МТ (p=0,048 по сравнению с пациентами, получавшими монотерапию МТ). Сходные данные получены при оценке эффективности ритуксимаба с использованием индекса DAS28. Только у 5% пациентов, леченных МТ, по сравнению с 20% пациентов, получавших ритуксимаб, имел место «хороший ответ» (снижение DAS>1,2 и низкая активность заболевания — DAS28<2,4). Число пациентов, «не отвечающих» на терапию (снижение DAS<0,6 или DAS28>3,7) составило соответственно 50% в группе, получавшей МТ и 18% — ритуксимаб. К 48 неделе в группах пациентов, получавших ритуксимаб, эффект по ACR50 был существенно выше, чем у пациентов, получавших монотерапию МТ (p=0,002). В процессе лабораторного исследования в динамике было установлено, что лечение ритуксимабом приводит к быстрому и стойкому снижению титров РФ, а также CD19 клеток (отражает «истощение» В-клеток). Примечательно, что несмотря на снижение числа В-лимфоцитов, существенного уменьшения концентрации основных классов иммуноглобулинов (IgG, IgA, IgM) у пациентов, получавших ритуксимаб, не отмечено.
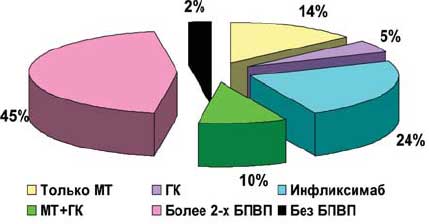
В РКИ DANCER (Dose-ranging Assessment International Clinical Evaluation of Rituximab in RA) [23] вошли пациенты с серопозитивным по РФ умеренно тяжелым и тяжелым РА, которые были резистентны, по крайней мере, к одному БПВП (включая ингибиторы ФНО — 27-32%) и с недостаточной эффективностью МТ. Больные были разделены на 3 группы, одна из которых получала монотерапию МТ (n=122), а две других — комбинированную терапию МТ и ритуксимаб в различных дозах (123 и 122 пациента). Кроме того, специально исследовалась эффективность глюкокортикоидной терапии в виде внутривенного или комбинированного введения. Было установлено, что комбинированная терапия МТ и ритуксимабом достоверно эффективней монотерапии МТ. «Ответ» по критерию ACR20 имел место у 28% в группе плацебо и у 54-55% получавших ритуксимаб, по критерию ACR 50 — соответственно, у 13, 33 и 34% пациентов, а по критерию ACR70 — у 5, 13 и 20% (p=0,029 и p<0,001) (рис. 3). При этом достоверных различий в эффективности терапии у пациентов, получавших 500 мг и 1000 мг ритуксимаба, не отмечено. Установлена высокая эффективность повторных курсов ритуксимаба, не уступающих первому курсу (рис. 4). Установлено также, что прием глюкокортикоидов перед введением ритуксимаба не влияет на эффективность, но снижает частоту посттрансфузионных реакций.
В РКИ REFLEX (Rituximab for Rheumatoid Arthritis Refractory to Anti-Tumor Necrosis Factor Therapy) были включены пациенты с неэффективностью (или непереносимостью) по крайней мере, одного ингибитора ФНО-a [24]. В группе получавших ритуксимаб у значительно большего числа пациентов был получен клинически «ответ» по критериям АCР и EULAR (рис. 5), наблюдалось улучшение параметров качества жизни — опросники FACIT-F, HAQ и SF-36 (табл. 2). Предварительный анализ результатов исследования REFLEX свидетельствует о том, что комбинированная терапия ритуксимабом и МТ более эффективно тормозит деструкцию суставов, чем монотерапия МТ (рис. 6, 7).
Совсем недавно группа авторитетных европейских ревматологов разработала рекомендации по применению ритуксимаба при РА [25] (табл. 3), в которых подчеркивается, что основным показанием для его назначения в настоящее время является неэффективность ингибиторов ФНО-a. Кроме того, ритуксимаб может назначаться пациентам, имеющим противопоказания для лечения ингибиторами ФНО-a, особенно при наличии в анамнезе туберкулеза, лимфопролиферативных опухолей, а также при ревматоидном васкулите. Противопоказаниями для проведения терапии являются гиперчувствительность к ритуксимабу (или другим мышиным белкам), тяжелая инфекция и сердечная недостаточность (класс NYHA IV), беременность.
Наиболее частым побочным эффектом при лечении ритуксимабом являются инфузионные реакции (как правило, умеренные), частота которых снижается при повторных инфузиях. В РКИ отмечено умеренное нарастание частоты тяжелых инфекций. Однако в отличие от ингибиторов ФНО-a ритуксимаб не увеличивает риска туберкулеза и оппортунистических инфекций.
Таким образом, ритуксимаб является чрезвычайно перспективным препаратом для лечения наиболее тяжелых форм РА, внедрение которого в широкую клиническую практику позволит улучшить прогноз у многих пациентов, страдающих этим заболеванием.






Литература
1. Gabriel SE. The epidemiology of rheumatoid arthritis. Rheum Dis Clin North Аmer 2001;27: 269-281
2. El-Gabalawy HD, Lipsky PE. Why do we not have a cure for rheumatoid arthritis? Arthritis Rheum, 2002:4 (suppl 3): S297-S301
3. Насонов Е.Л. Фармакотерапия ревматоидного артрита — взгляд в 21 век. Клин. медицина 2005; 6: 8-12
4. Насонов Е.Л. Лечение ревматоидного артрита: современное состояние проблемы. РМЖ 2006; 14 (8); 573-577
5. Choy EH, Panayi CS. Cytokine pathways and joint inflammation in rheumatoid arthritis. N Engl J Med 2001; 344: 907-16.
6. Ferestein GS. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest 2004; 114: 471-4.
7. Skapenko A, Leipe J, Lipsky PE, Schulze-Koops H. The role of the T cell in autoimmune inflammation. Arthritis Res Ther 2005; 7: (Suppl. 2): S4-S14
8. Насонов Е.Л. Применение инфликсимаба (моноклональные антитела к фактору некроза опухоли) в ревматологии: новые данные. РМЖ 2004; 20: 1123-1127.
9. Scott DL, Kingsley GH. Tumor necrosis factor inhibitors for rheumatoid arthritis. New Engl J Med 2006; 355: 704-712
10. Kotzin BL. The role of B cells in the pathogenesis of rheumatoid arthritis. J Rheumatol 2005;
11. Zhang Z, Bridges SL Jr. Pathogenesis of rheumatoid arthritis: role of B lymphocytes. Rheum Dis Clin North Am. 2001; 27:335-353.
12. Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human antibody to CD20. Blood. 1994; 83:435-445.
13. Golay J, Zaffaroni L, Vaccari T, et al. Biological response of B lymphoma cells to anti-CD20 monoclonal antibody rituximab in vitro: CD55 and CD59 regulate complement-ted cell lysis. Blood 2000; 95:3900-8.
14. Johnson P, Glennie M. The mechanism of action of rituximab in the elimination of tumor cells. Semin Oncol 2003 (Supp 2); 30:3-8.
15. Edwards JCW, Cambridge G. Sustained improvement in rheumatoid arthritis following a protocol deed to deplete B lymphocytes. Rheumatology (Oxford). 2001;40:205-211
16. Leandro MJ, Edwards JCW, Cambridge G. Clinical outcome in 22 patients with rheumatoid arthritis treated with B lymphocyte depletion. Ann Rheum Dis. 2002; 61:883-888
17. De Vita S, Zaja F, Sacco S, De Candia A, Fanin R, Ferraccioli G. Efficacy of selective B cell blockade in the treatment of rheumatoid arthritis. Arthritis Rheum. 2002; 46:2029-2033
18. Kramm H, Hansen KE, Gowing E, Bridges A. Successful therapy of rheumatoid arthritis with rituximab. Renewed interest in the role of B cells in the pathogenesis of rheumatoid arthritis. J Clin Rheumatol. 2004; 10:28-32.
19. Kneitz C, Wilhelm M, Tony HP. Improvement of refractory rheumatoid arthritis after depletion of B cells. Scand J Rheumatol. 2004; 33:82-86.
20. Cambridge G, Leandro MJ, Edwards JC, et al. Serologic changes following B lymphocyte depletion therapy for rheumatoid arthritis. Arthritis Rheum. 2003; 48:2146-2154
21. Насонов Е.Л. Перспективы применения моноклональных антител в В-лимфоцитам (ритуксимаб) при ревматоидном артрите. Клин. Фармакол. терапия 2006; 1-5:55-58
22. Edwards CW, Szczepanski L, Szechinski J, et al. Efficacy of B-cell-Targeted therapy with rituximab in patients with rheumatoid arthritis. New Engl J Med 2005; 350: 2572-2581.
23. Emery P, Fleishmann R, Filipowicz-Sosnowska A, et al. for the DANCER Study group. The Efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment. Results of a phase IIb randomized, double-blind, placebo-controlled dose-range trial. Arthritis Rheum 2006; 54: 1390-1400
24. Cohen SB, Emery P, Greenwald MW, et al. fpt the REFLEX Trial Group. Rituximab for theumatoid arthritis refractory to anti-tumor necrosis factor therapy. Results of multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54: 2793-2806
25. Smolen JS, Betteridge N, Breedveld FC, et al. Consensus ement on the use of rituximab in patients with rheumatoid arthritis. Ann Rheum Dis 26 Oct 2006.
Первый опыт применения моноклональных антител к В-лимфоцитам (Ритуксимаб) при ревматоидном артрите в России
Статьи
Материалы совещания экспертов по регистру пациентов с ревматоидным артритом, получающих ритуксимаб (Мабтеру):
Опубликовано в журнале:
«Научно-практическая ревматология» 2008, приложение к № 1, С. 11-14
Г.В. Лукина, ЕЛ. Насонов, Я.А. Сигидин, К.Х. Кузикянц , Л.А. Базевич, Т.И.Злобина, Р.Г. Камалова, Л.А. Князева, В.И. Мазуров, Л.В. Меньшикова, А.Э. Сизиков, Е.А. Смирнова, Н.А. Фофонова, Т.В. Шабалина, Л.М. Шкиль, Н.В. Юдина, С.С. Якушин
Предварительные результаты Российского регистра
Патология Т-клеточных иммунных реакций в течение нескольких десятилетий считается основной в развитии РА. Однако, за последние годы выяснено, что В-клетки могут участвовать в патогенезе РА не только как продуценты аутоантител (в частности, ревматоидного фактора — РФ), но и как антиген-презентирующие клетки — представляя артритогенный аутоантиген Т-клеткам. В результате Т-клетки активируются и продуцируют провоспалительные цитокины. Важная роль В-клеток в развитии ревматоидного процесса подтверждается также лечебным эффектом анти-В-клеточного препарата ритуксимаб при РА.
Ритуксимаб представляет собой химерное моноклональное антитело к молекуле СD20, находящейся на поверхности пре-В-клеток и зрелых В-клеток, но отсутствующей на стволовых клетках и на продуцентах антител — плазматических клетках. Введение препарата ритуксимаб, применяемого в течение 10 лет для лечения лимфом, приводит к быстрому и глубокому (почти до нуля) падению числа В-клеток в периферической крови, длящемуся до 6 месяцев и более.
Проведенные исследования показали высокую эффективность и хорошую переносимость ритуксимаба у больных с тяжелым РА, у которых предшествующая терапия МТХ и блокаторами ФНО оказалась неэффективной.
В заявлении-консенсусе 2007 г. указывается, что целесообразность назначения ритуксимаба может рассматриваться не только после неэфективности предшествующего лечения блокаторами ФНО-α, но и при наличии противопоказаний к этим средствам. Таким образом, признается, что ритуксимаб может быть первым среди биологических препаратов, назначаемых больному РА. У больных РА с сопутствующей В-клеточной лимфомой (в том числе в прошлом) ритуксимаб является препаратом выбора.
С сентября 2006 года ритуксимаб разрешен для лечения РА в России, и в апреле 2007 года был создан Российский регистр больных РА, получающих этот препарат. Данное сообщение представляет собой анализ первых результатов применения ритуксимаба в России. Мы полагаем, что наш опыт окажется полезным для ревматологов, которым предстоит работать с этим препаратом.
Материал и методы.
К настоящему времени один полный курс лечения ритуксимабом (2 инфузии) получили 42 больных РА (социальный статус больных представлен на диаграмме 1). Среди них было 38 женщин и 4 мужчины; средний возраст составил 50,1±10,4 лет, средняя длительность заболевания -8,5±6,2 лет. Серопозитивных по ревматоидному фактору (РФ) было 39 больных (93%). II рентгенологическая стадия РА диагностирована у 15 пациентов, III — у 24 и IV — у 3. Функциональная недостаточность суставов I степени была у 2 больных, II — у 35 и III — у 5. У 35 пациентов (83%) отмечались системные проявления (диаграмма 2). Клиническая характеристика больных представлена в таблице 1. Предшествующая терапия показана на диаграмме 3.
Диаграмма 1. Социальный статус пациентов
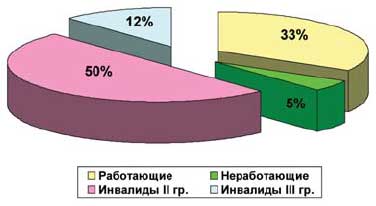
Диаграмма 2. Системные проявления РА
Таблица 1. Клиническая характеристика больных
| Выраженность боли (ВАШ*, мм.) | 68,0 ± 19,4 |
| Утренняя скованность (мин) | 220,3 ± 217,7 |
| Число воспаленных суставов (из 66) | 15,0 ± 12,2 |
| Число болезненных суставов (из 68) | 20,3 ± 13,0 |
| СОЭ, мм/час. | 38,66 ± 12,6 |
| СРБ, мг/л | 28,2 ± 32,2 |
| Оценка тяжести состояния (ВАШ, мм) пациентом | 66,1 ± 19,4 |
врачом | 67,1 ± 19,5 |
| DAS28 | 6,6 ± 0,9 |
| Гемоглобин (г/л) | 113,1 ± 13,2 |
| Лейкоциты (тыс. в 1 куб. мм) | 8,6 ± 8,2 |
| Нейтрофилы (%) | 67,4 ± 15,3 |
| Тромбоциты (тыс. в 1 куб. мм) | 304,1 ± 95,8 |
Диаграмма 3. Предшествующая терапия
Конкретными показаниями к назначению ритуксимаба были: неэффективность инфликсимаба у 4 пациентов, его непереносимость у 6, неэффективность предшествующей традиционной базисной терапии у 25 (в том числе двумя и более базисными препаратами, включая метот-рексат, у 22), непереносимость предшествующей базисной терапии у 5, высокая лабораторная активность у 1. Одной больной с ранним РА ритуксимаб был назначен в качестве первого базисного препарата с целью возможно более быстрого достижения ремиссии.
В качестве основного показателя лечебного эффекта ритуксимаба была избрана динамика показателя DAS28. Отдельно учитывались также уровень В-клеток (СD19+), РФ, С-реактивного белка (СРБ), иммуноглобулинов (Ig) M, A и G, стандартные гематологические показатели.
Большинству пациентов (37) ритуксимаб вводился по классической схеме: 2 внутривенных инфузии по 1000 мг с интервалом 2 недели. Перед каждым введением проводилась премедикация — 100 мг метилпреднизолона внутривенно капельно. Пять пациентов получили 2 инфузии ритуксимаба по 500 мг каждая.
Результаты и обсуждение.
Назначение ритуксимаба привело к резкому падению уровня В-клеток в периферической крови у всех больных, которым оценивался данный показатель, до очень низкого уровня, близкого к нулю; в препаратах определялись лишь единичные клетки (диаграмма 4).
Диаграмма 4. Динамика уровня В-клеток (CD 19) при лечении ритуксимабом
В результате проведенной терапии наблюдался значительный положительный эффект, наиболее отчетливо проявившийся в динамике числа воспаленных (ЧВС) и болезненных (ЧБС) суставов. Эти показатели достоверно снизились уже к 8-й неделе. Затем они продолжали неуклонно снижаться в течение дальнейшего периода наблюдения и достигли очень низких величин к 24-й неделе (диаграмма 5).
Диаграмма 5. Динамика числа воспалённых (ЧВС) и болезненных (ЧБС) суставов
Заметно снизились также лабораторные показатели воспалительной активности — СОЭ и СРБ (диаграммы 6 и 7). Особенно следует отметить значительное и сравнительно быстрое уменьшение титра РФ (диаграмма 8), несмотря на отсутствие достоверного снижения уровня IgМ (диаграмма 9), к которому относится стандартно определяемый РФ. Это обстоятельство в некоторой степени подтверждает предположение о более выраженном разрушении ритуксимабом В-клеток, продуцирующих аутоантитела. Содержание IgA и показателей периферической крови (диаграмма 10) не претерпело изменений. В то же время уровень IgG к 16-й неделе достоверно снизился. Таким образом, нельзя полностью исключить влияние ритуксимаба на количество или функцию плазматических клеток, несмотря на то, что на них отсутствует антиген CD20.
Диаграмма 6. Динамика СОЭ
Диаграмма 7. Динамика концентрации СРБ
Диаграмма 8. Динамика ревматоидного фактора
Диаграмма 9. Динамика уровня иммуноглобулинов
Диаграмма 10. Динамика показателей периферической крови
При индивидуальной оценке эффективности терапии было отмечено постепенное нарастание положительных результатов. Так, по критерию DAS28 хороший и удовлетворительный результаты через 8 недель регистрировались у 62% больных, через 16 недель — у 86%, а через 24 недели — 100% (диаграмма 11). Относительно медленное и постепенное развитие клинического улучшения при назначении ритуксимаба соответствует гипотезе о том, что основным механизмом лечебного действия этого препарата является торможение антиген-представляющей функции В-клеток.
Диаграмма 11. Оценка эффективности терапии по критериям EULAR через 8 (n=34), 16 (n=14) и 24 (n=8) недели (%)
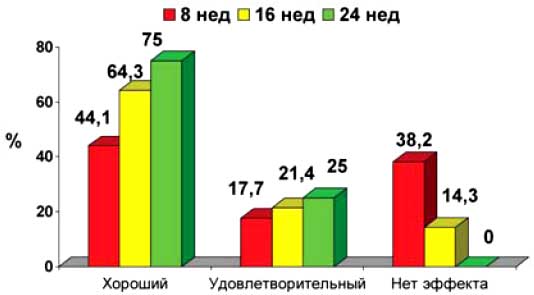
Обращает внимание, что эффект терапии не обнаружил параллелизма с выраженностью снижения уровня В-клеток. По-видимому, снижение их уровня само по себе еще не является достаточным условием для развития клинического улучшения при РА.
Переносимость ритуксимаба была хорошей. В основном регистрировались только инфузионные реакции в виде отека лица и заложенности носа у одного пациента, парестезий верхних дыхательных путей у 2 больных, гиперемии и зуда ушных раковин у 2, гриппоподобного синдрома у 2 пациентов. У одной больной с сердечной недостаточностью I стадии после 2-й инфузии наблюдалось усиление одышки и болей в области сердца.
Таким образом, применение ритуксимаба для лечения РА не только открыло новое направление в антиревматической биологической терапии, но и расширило представления о патогенезе этого заболевания, подчеркнув важную роль В-клеток. Этот препарат заслуживает широкого применения при лечении тяжелых больных РА, рефрактерных к предшествующей терапии, включая блокаторы ФНО-а. Его переносимость оказалась вполне удовлетворительной.
Ближайшими задачами в исследовании ритуксимаба являются разработка показаний к проведению его повторных курсов и оценка его антидеструктивного действия.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- Мустафин Р. И., Протасова А. А., Буховец А. В., Семина И.И. Исследование интерполимерных сочетаний на основе (мет)акрилатов в качестве перспективных носителей в поликомплексных системах для гастроретентивной доставки. Фармация. 2014; 5: 3–5.
- Puccinotti, «Storia della medicina» (Ливорно, 1954—1959).
- Bangun H., Aulia F., Arianto A., Nainggolan M. Preparation of mucoadhesive gastroretentive drug delivery system of alginate beads containing turmeric extract and anti-gastric ulcer activity. Asian Journal of Pharmaceutical and Clinical Research. 2019; 12(1):316–320. DOI: 10.22159/ajpcr.2019.v12i1.29715.
- https://www.rmj.ru/articles/revmatologiya/Novye_napravleniya_terapii_revmatoidnogo_artrita_perspektivy_primeneniya_monoklonalynyh_antitel_k_Vlimfocitam_rituksimab/.
- https://medi.ru/info/1567/.
- Debjit B., Rishab B., Darsh G., Parshuram R., Sampath K. P. K. Gastroretentive drug delivery systems- a novel approaches of control drug delivery systems. Research Journal of Science and Technology;10(2): 145–156. DOI: 10.5958/2349-2988.2018.00022.0.
- Baas, «Geschichte d. Medicin».
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Доклиническое изучение противоопухолевой активности производного индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. № 1. С. 129.
- Puccinotti, «Storia della medicina» (Ливорно, 1954—1959).